プレMAF療法 プレMAFの技術情報 マクロファージとは Gc typeについて Pre-MAF therapy Pre-MAF technical information What are macrophages?
プレMAFの技術情報
トップページ
- プレMAFの技術情報
プレMAFに関する実験
- マウス腹腔マクロファージを用いた貪食活性評価試験(徳島大学との共同研究結果)
-
試験方法
ICRマウス(♀、8 weeks)を頸椎脱臼し、マウス腹腔マクロファージを回収した.回収後、Burker-Turk型血球計算版にて1.0×106 cells/mLに調整した.24穴プレートに滅菌したカバーガラスを入れ、採取・調整した腹腔内細胞液を5.0×105 cells/well分注の上、カバーガラスにマクロファージを定着(37℃・1 h)させた.定着後、腹腔内細胞液をエッペンチューブに回収し、サンプル(Gc globulin, プレMAF)及び比較としてRPMI培地(control)を加え、反応させた(37℃・1 h).定着させたカバーガラスは、RPMI培地にて洗浄の上、インキュベート(37℃・15 h)を行った.インキュベート後、腹腔液処理サンプルをそれぞれ添加し、マクロファージを刺激(37℃・3 h)し、0.5%オプソニン化SRBCを加え、貪食させた(37℃・1.5 h).貪食後、洗浄の上、ギムザ染色し、顕微鏡にて検鏡を行った.
* :RPMI培地のみ
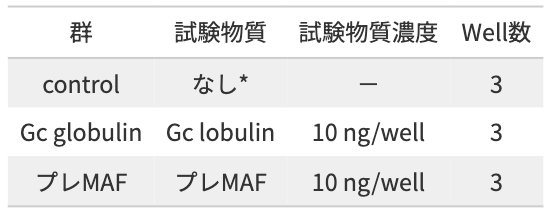
試験結果
プレMAFの投与により、免疫細胞の1つであるマクロファージが活性化させる事、Gc globulinだと活性化されない事を示している。Gc globulinからプレMAFへの変換は必要であることが示唆された。
- マウス腹腔マクロファージを用いた貪食活性経時変化評価試験(徳島大学との共同研究結果)
-
試験方法
ICRマウス(♀、8 weeks)を頸椎脱臼し、マウス腹腔マクロファージを回収した.回収後、Burker-Turk型血球計算版にて1.0×106 cells/mLに調整した.
24穴プレートに滅菌したカバーガラスを入れ、採取・調整した腹腔内細胞液を5.0×105 cells/well分注の上、カバーガラスにマクロファージを定着(37℃・1 h)させた.定着後、腹腔内細胞液をエッペンチューブに回収し、サンプル(Gc globulin, プレMAF)及び比較としてRPMI培地(control)を加え、反応させた(37℃・1 h).定着させたカバーガラスは、RPMI培地にて洗浄の上、インキュベート(37℃・15 h)を行った.
インキュベート後、腹腔液処理サンプルをそれぞれ添加し、マクロファージを刺激(37℃・3 h)し、0.5%オプソニン化SRBCを加え、貪食させた(37℃・1.5 h).貪食後、洗浄の上、ギムザ染色し、顕微鏡にて検鏡を行った.
* :RPMI培地のみ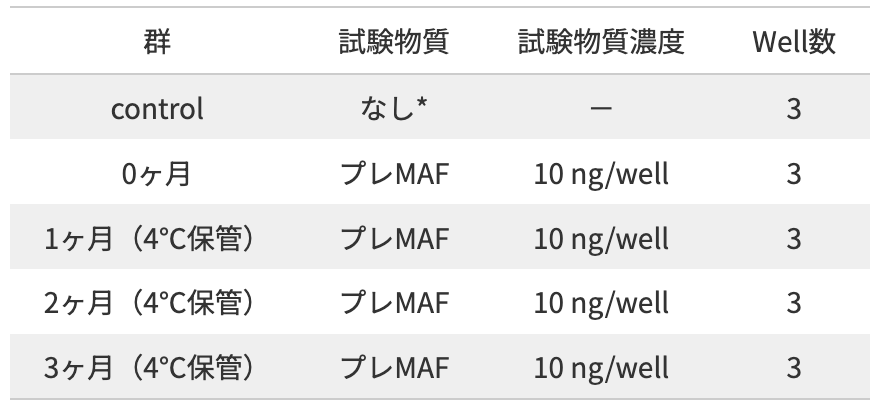
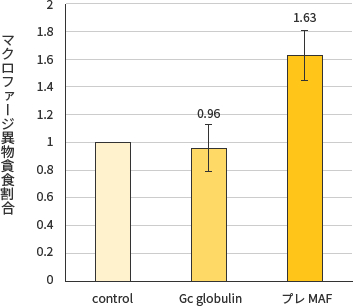
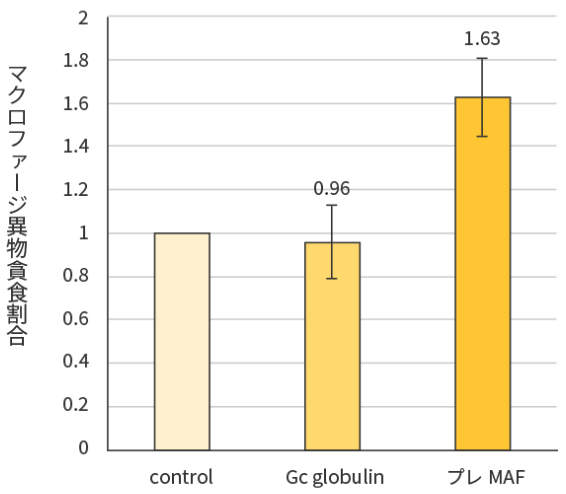
試験結果
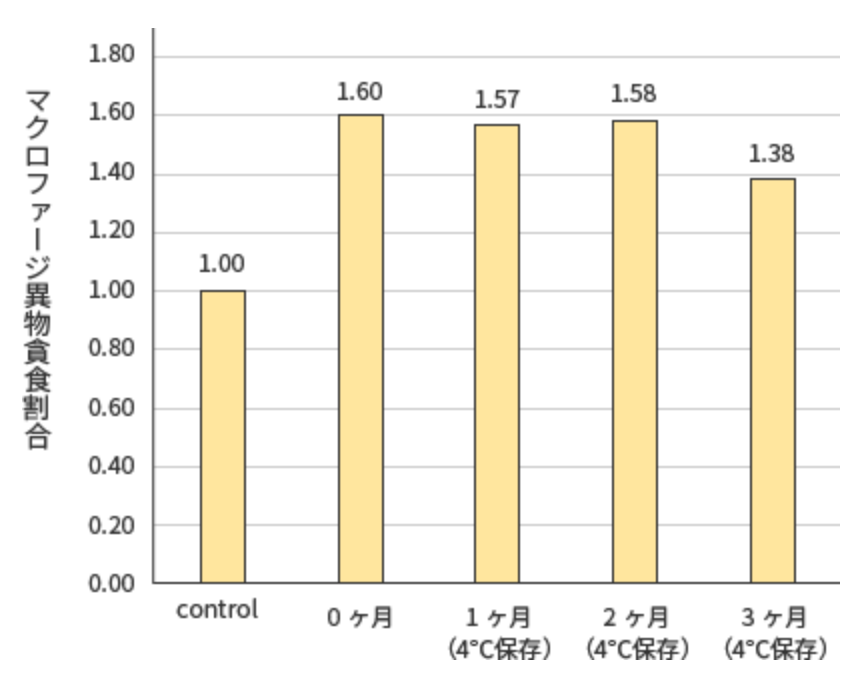
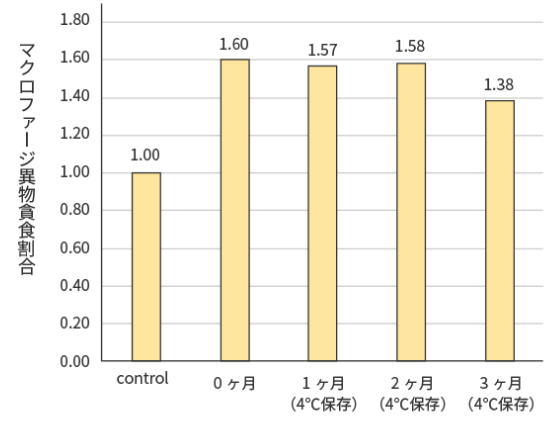
プレMAFは冷蔵保管3ヶ月でもマクロファージを活性化することが示唆された。
- ヒトPBMC付着細胞分画の貪食能評価(東京慈恵会医科大学との共同研究結果)
-
試験方法
健常成人ボランティアよりヘパリン採血で末梢血を約20ml採取した。Ficoll density gradient centrifugation法を用いてPBMCを採取し、無血清RPMI-1640培地に細胞を浮遊させ10cm Petri Dishに植え込んだ。プレMAF(PBMCの由来した同一健常ボランティアのGcより作製)、または、コントロールのPBSをPBMC培養の培地に添加し4時間培養した。その後、温PBSで細胞を洗浄し、浮遊細胞と培地を除いた。
培養した付着細胞分画の貪食能をPhagocytosis Assay Kit (IgG FITC, Cayman) を用いて、IgGでcoatingされた蛍光ビーズを付着細胞に加え90分間培養した。洗浄後、蛍光顕微鏡によりランダムに10視野を撮影した。蛍光顕微鏡写真をWinROOFを用いて解析し、写真に占める蛍光の面積絶対値を求めマクロファージの貪食能として評価した。試験結果
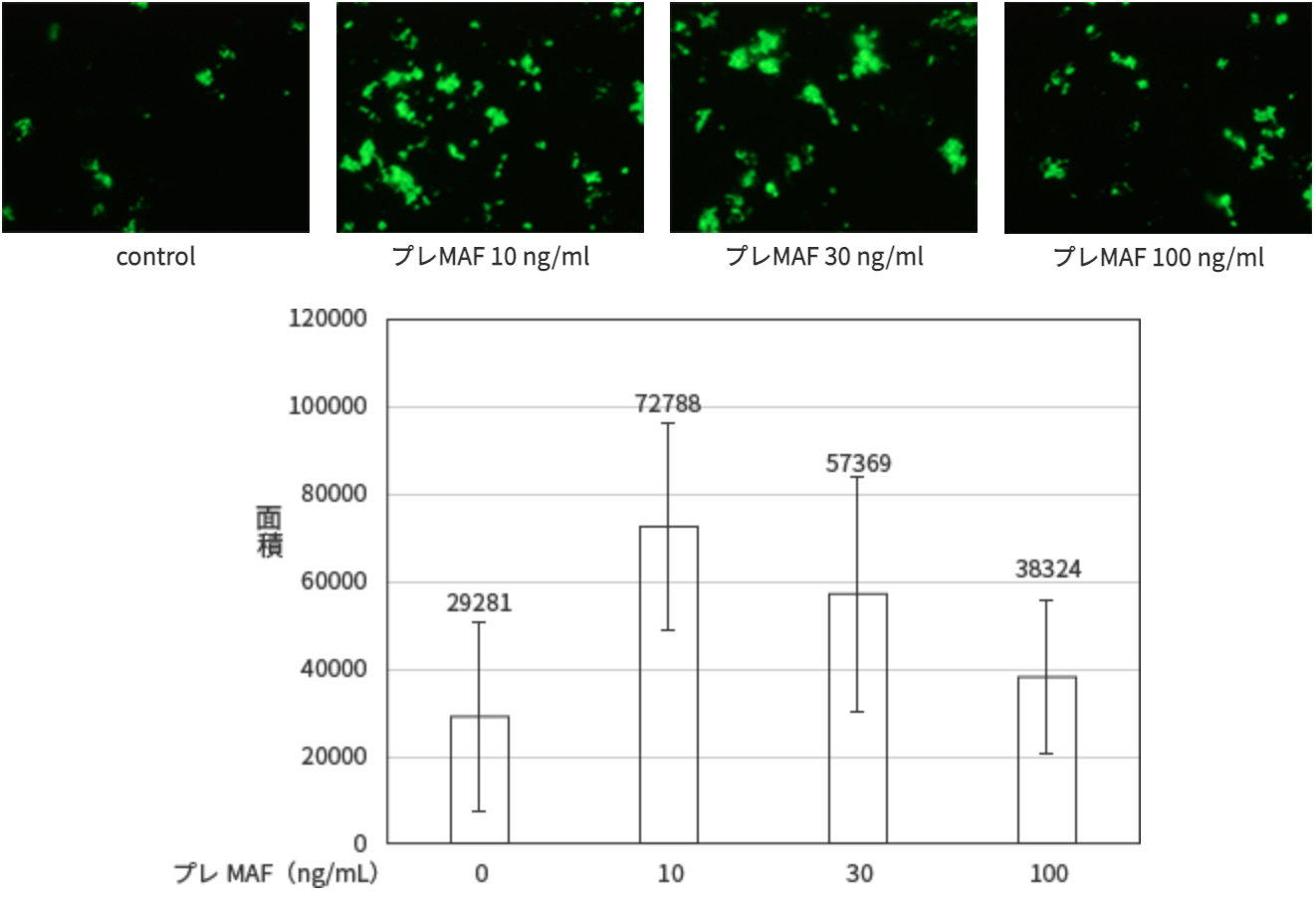
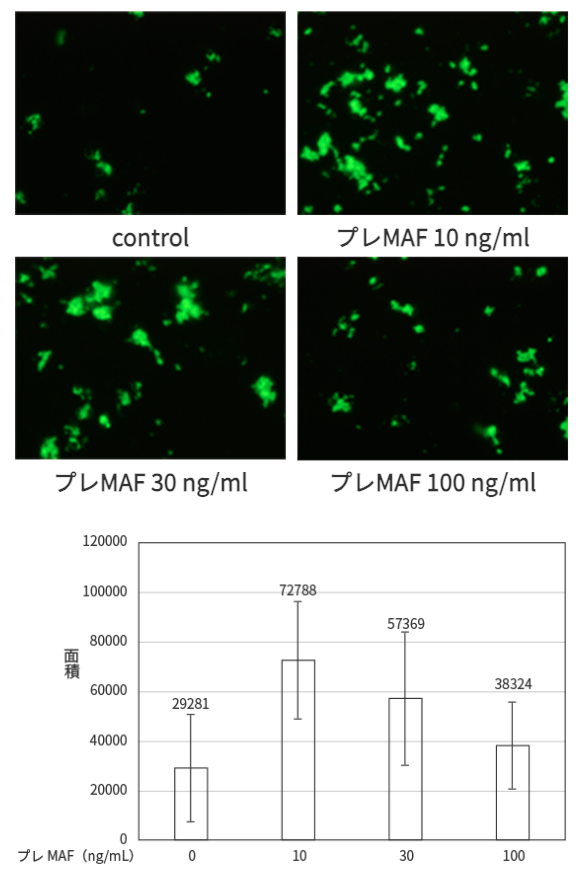
ヒトPBMC付着細胞分画はプレMAF処理により明らかな貪食能の増加が認められ、10ng/mlのプレMAFで最も強い貪食能の増加が認められた。
- 血管新生阻害活性評価試験(ジーン・ステム㈱への委託結果)
-
試験方法
48 well plate にMatrigelを200 µL/wellコーティングし、HUVECを1万細胞/ 200 µL/wellにて培養した.培養にはHuMedia-EB2にFCSを1%濃度で加えたMediumを用いた.
Medium にはrecombinant human VEGF165(hVEGF165)を10 ng/mlの最終濃度になるように添加し、加えて試験物質を添加した(下記表を参照).培養開始から12~16時間後に写真を撮影し、形成されたtubeの長さ、分岐点を定量化した.測定結果はOMS社の統計解析ソフト「Statcel2」を用いて、全ての群間の比較を一元配置分散分析法(ANOVA)とTukey-Kramer法により有意差があるかどうかを検定した.
※:0.1% DMSO含有リン酸緩衝生理食塩水(PBS)(-)を添加

試験結果
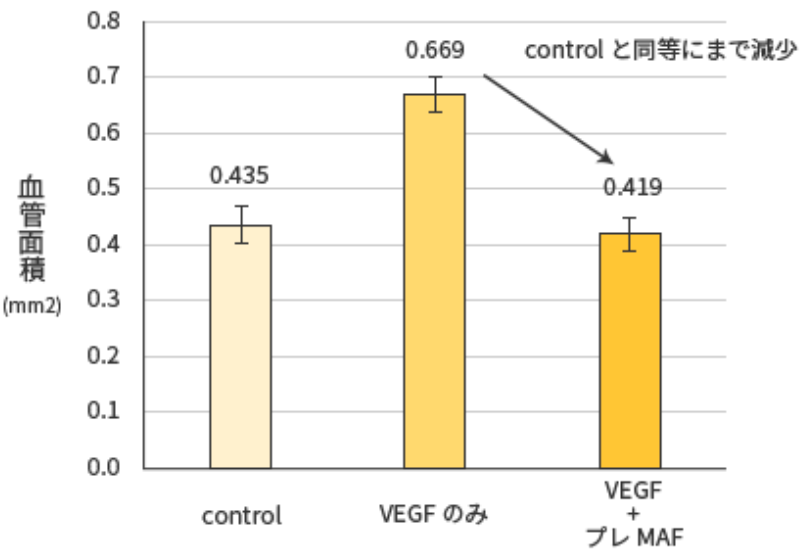

プレMAF投与により、血管新生が抑制されている事が分かります。つまり、プレMAFにはがん細胞に酸素・栄養素を供給する経路となる血管の増殖が抑えられている事を示している。 血管新生とは?
がん細胞は、自身が成長する為に必要な酸素や栄養を得る為に、新しい血管を形成しようと働く。この、新しい血管が形成されることを「血管新生」と呼ばれている。
この新生された血管は、がん細胞への酸素や栄養の供給を行うだけでなく、がん転移の経路も果たしているとも考えれらている。VEGFとは
血管内皮細胞増殖因子(vascular endothelial growth factor)の略。
血管新生に関与する一群の糖タンパク質であり、VEGFの過剰発現は腫瘍の血管増生や転移と関連している事が報告されている。
マクロファージ活性化による自身の自然免疫機能を向上させる事、酸素・栄養の供給血管新生を阻害する事、この2点でがん細胞の増殖等を抑制できるのではないかと考えられる。
- マウス肺がんに対する抗腫瘍評価試験(東京理科大学との共同研究結果)
-
試験方法
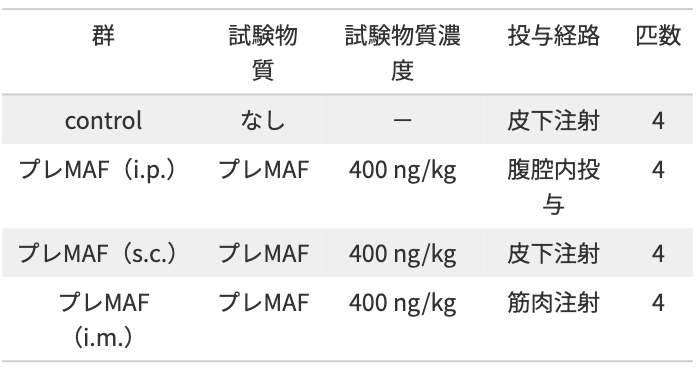
Lewis Lung Carcinoma(LLC)細胞は、100 mmプラスチックシャーレにおいて、10%ウシ胎児血清含有Dulbecco’s Modified Eagle Mediumにより37℃、5% CO2のもと培養した.培養上清を除き、LLC細胞を4℃のPhosphate Buffered Saline(PBS)に懸濁させ、4℃のもと200×gで5分間遠心し、さらに上清を除いた.沈殿したLLC細胞を4℃のPBSに懸濁させ、2×105 cellsのLLC細胞を1群4匹から成る6週齢のC57BL/6マウス(雄)の尾静脈内から注射した.
注射7日後から400 ng/kgのプレMAFを、腹腔内投与(i.p.)、皮下注射(s.c.)、筋肉注射(i.m.)にて10日間連続投与した.最終投与翌日にマウスを屠殺し、肺を実態顕微鏡により撮影の上、肺に形成された腫瘍結節数を計測した.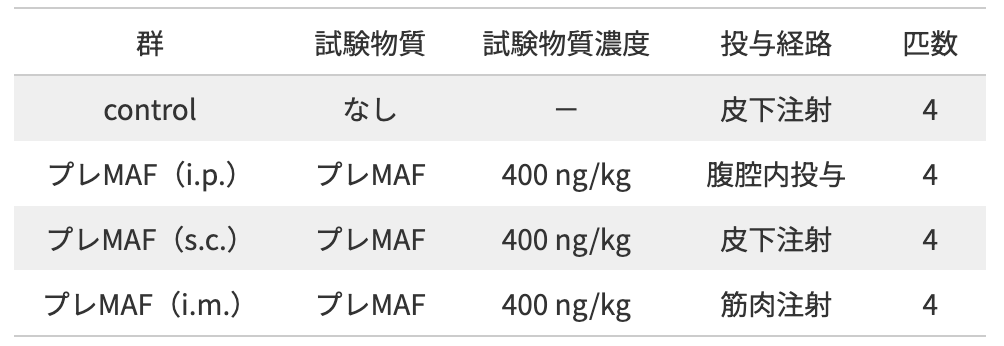
試験結果
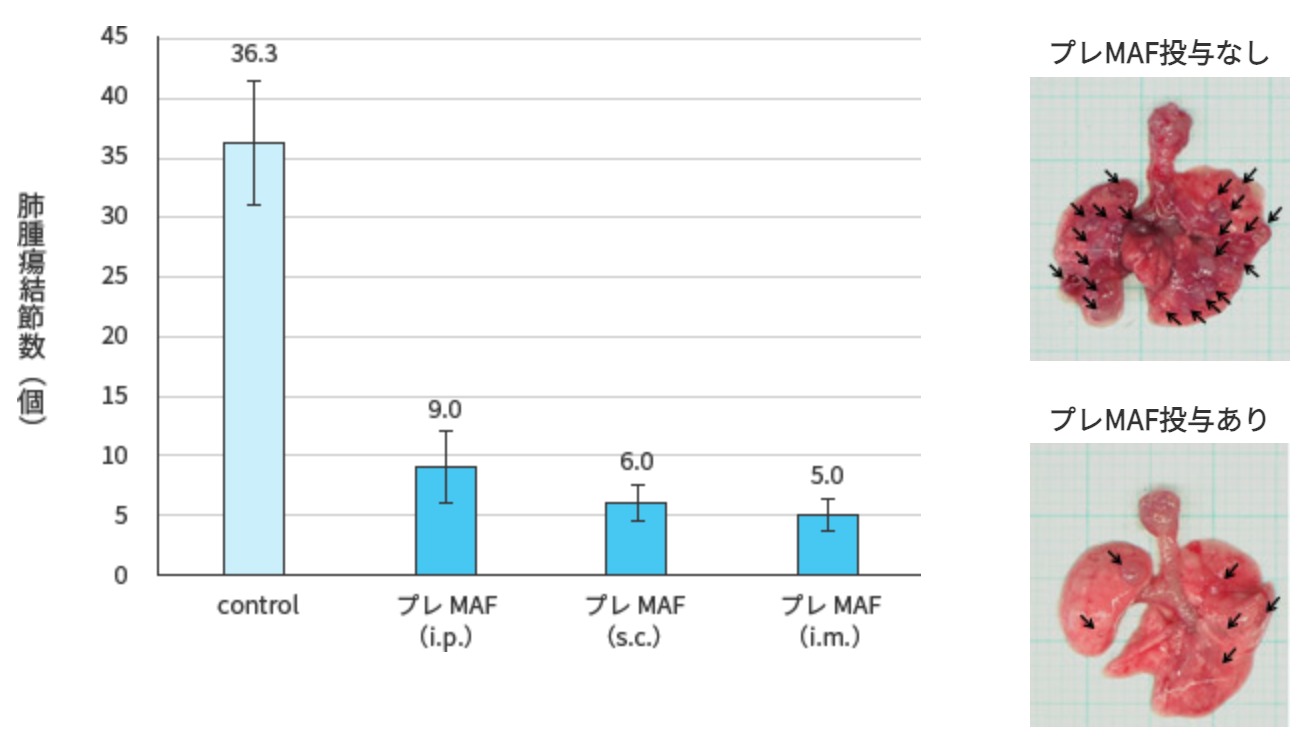
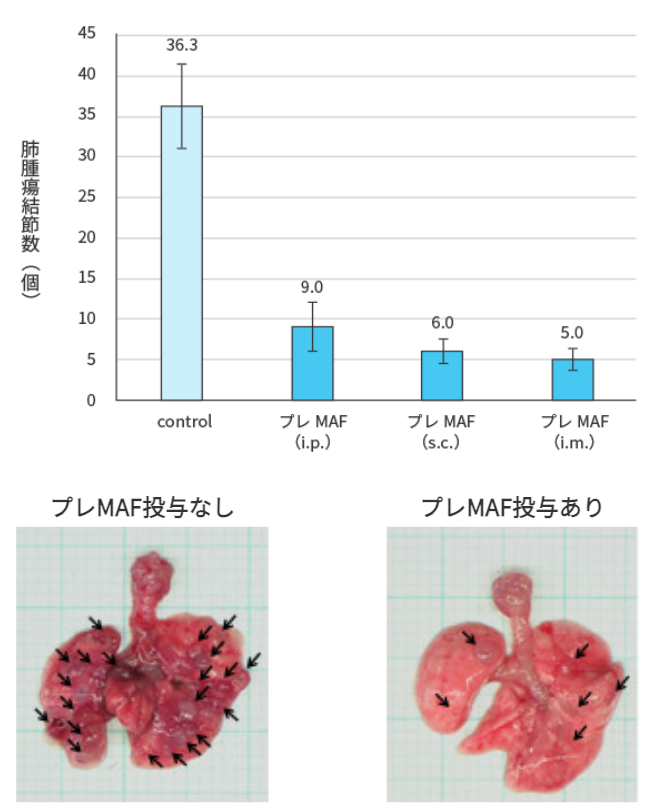
プレMAFはどの投与経路においても、肺に出来た腫瘍数が著しく減少している事が分かります。つまり、プレMAFには抗腫瘍効果がある事を示している。
- 抗体製剤との併用効果評価試験(東京慈恵会医科大学との共同研究結果)
-
試験方法
ヌードマウスの背部皮下に106/mouseのOE19細胞を移植した。マウスを4群に分け、無処置群、プレMAF, トラスツズマブ単独、または併用投与群とした。プレMAFは10ng/mouseを移植後5日目より10日間連続で皮下注射した。トラスツズマブは25µg/mouseを移植後5日目より3日間間隔で計4回腹腔内に投与した。腫瘍細胞を移植後、週1回の頻度で腫瘍径を垂直に交わる2方向からキャリパーを用いて計測し、その数字を乗じたものを腫瘍サイズ(mm2)として表した。
試験結果
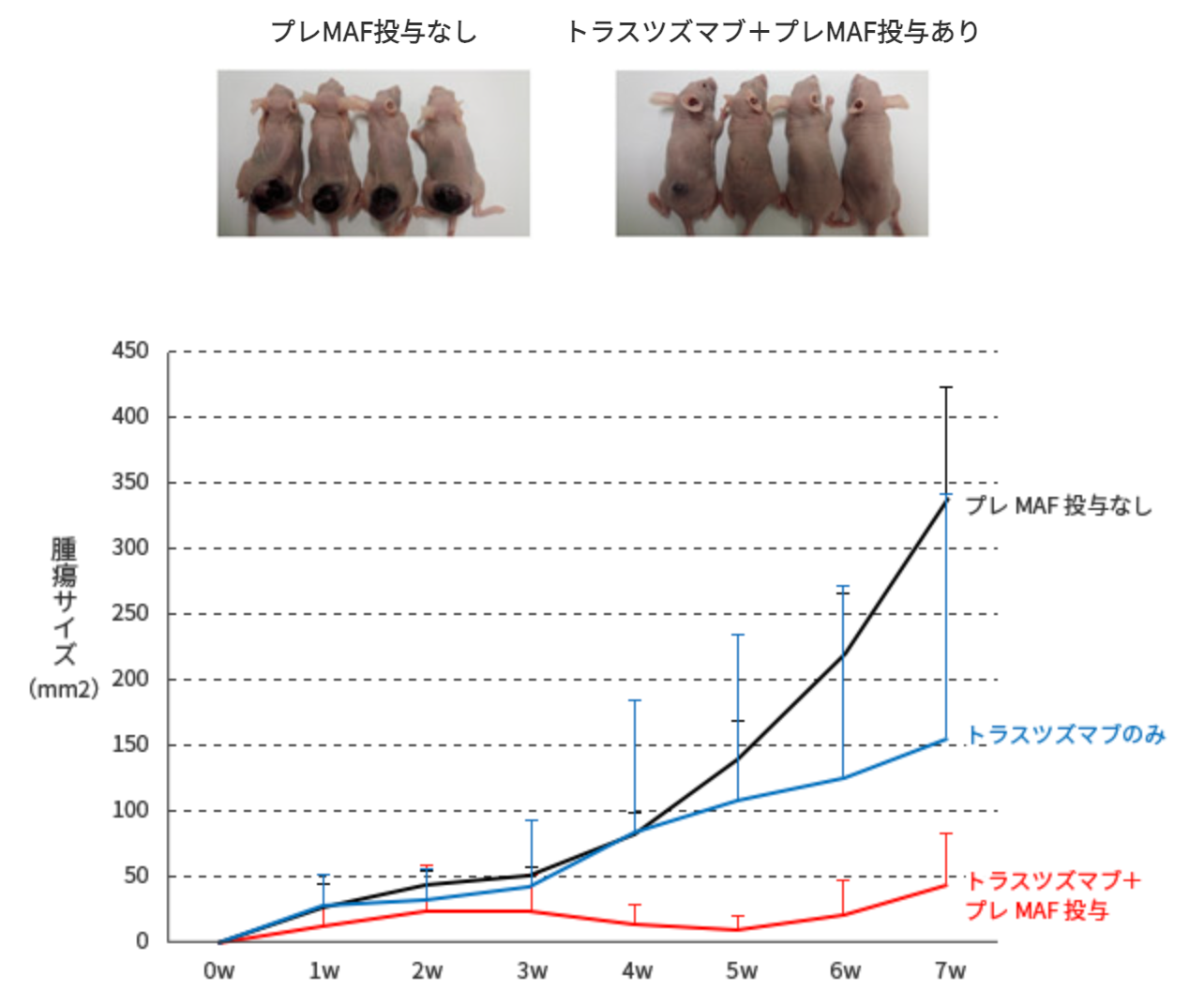
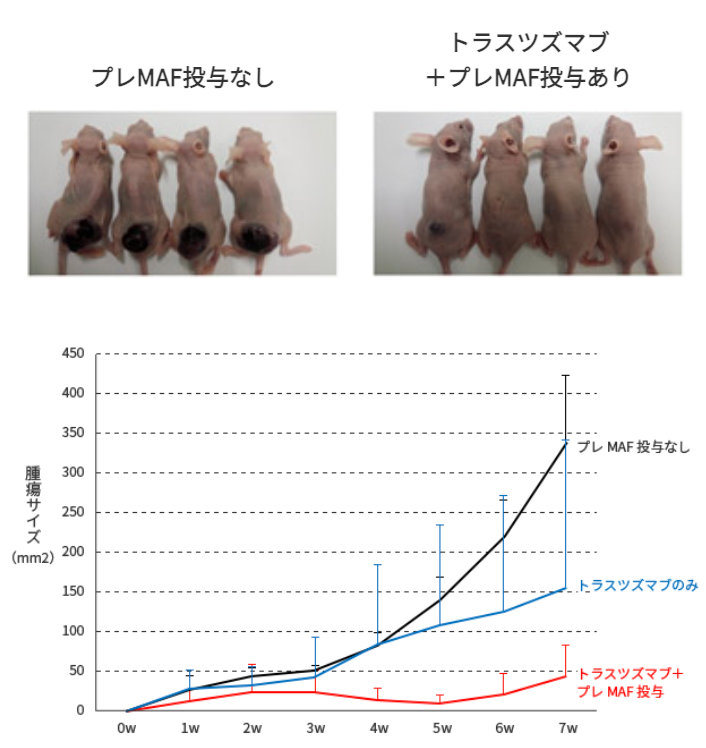
抗体製剤(トラスツズマブ)単独群より、プレMAFとの併用群の方が腫瘍サイズが著しく小さくなっている事が分かります。
つまり、プレMAFには抗体製剤との併用による抗腫瘍効果がある事を示している。
トラスツズマブとは
HER2蛋白に特異的に結合する事で抗腫瘍効果を発揮する分子標的治療薬の一種。
HER2に特異的に結合した後、NK細胞、単球を作用細胞とした抗体依存性細胞傷害作用(ADCC)により抗腫瘍効果を発揮する。
- 毒性評価試験(㈱DIMS医科学研究所への委託結果)
-
試験方法
6週齢 Crl:CD(SD)系ラットを体重層別法により、雌雄ともに6匹/群×3群に群分け。群分け後、プレMAFを週1回、13週間間歇皮下投与し、間歇皮下投与による毒性影響を検討した。
*:大塚生理食塩水を投与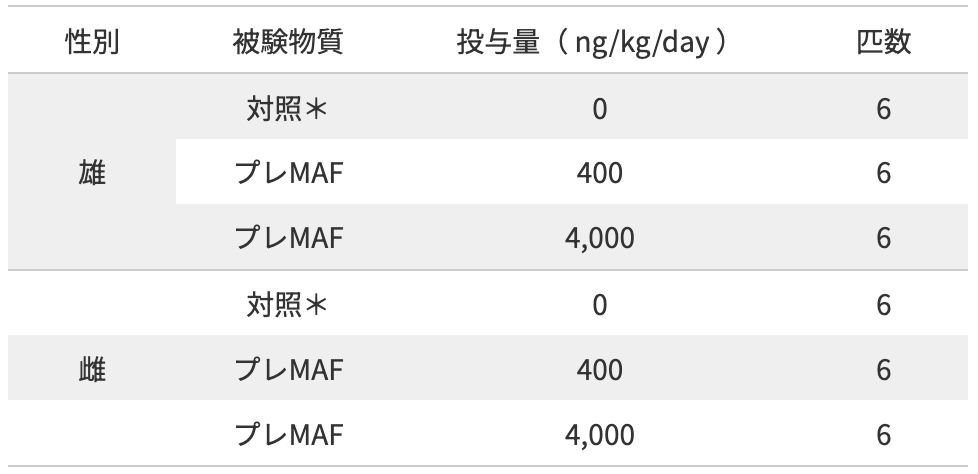
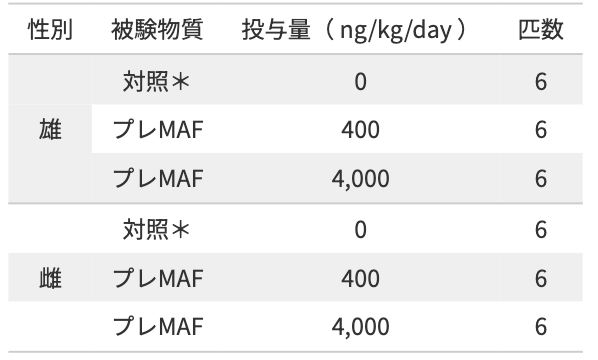
雌雄ともに、プレMAF(4,000 ng/kg/day)を13週間連続にて投与したマウスの死亡は認められず、異常は認められなかった。
これは、プレMAFの無毒性量(NOAEL)は、4,000 ng/kg/day(240 µg/60kg/day)以上である事を示している。

